Leucemia Mieloide Crónica
Dr. Salvador Bruno - Director del Instituto de Hematología de la Academia Nacional de Medicina
La leucemia mieloide crónica (LMC) es una enfermedad maligna caracterizada por una proliferación descontrolada de uno de los tipos de leucocitos, los granulocitos.
La LMC tiene una incidencia mundial de 0.87 personas por 100.000, aumentando con la edad a 1.52 por 100.000 en pacientes mayores de 70 años.
Tiene un pequeño predominio en hombres, y la edad media de diagnóstico es 56 años.
Los factores de riesgo predisponentes son desconocidos, pero existe un incremento de la incidencia de LMC entre los sobrevivientes de la bomba atómica en Japón.
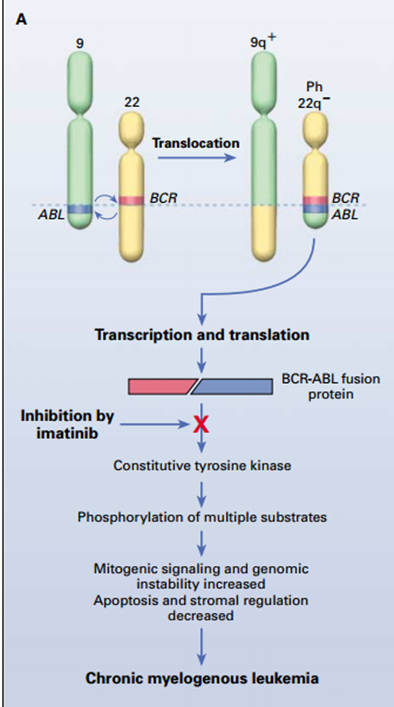
La LMC inicia por una alteración genética donde dos genes distintos, el ABL del cromosoma 9 y el BCR del 22 se translocan recíprocamente. Así, la fusión de los genes genera una onco-proteína BCR-ABL, llamada cromosoma Philadelphia por el lugar donde se describió originalmente, y está presente en el 90 a 95 % de los pacientes con la enfermedad.
Esta proteína de fusión actúa como una enzima tirosina quinasa defectuosa, afectando una serie de pasos metabólicos que conllevan a la proliferación desmedida de granulocitos.
La tirosinas quinasas son un conjunto de enzimas prtenecientes a la subfamilia de proteinas quinasas que se encuentran en la superficie de las celulas. Estas enzimas catalizan la fosforilacion de residuos de tirosina en proteinas diana, utilizando ATP
En la fase crónica la célula stem (madre) leucémica esta confinada a los tejidos hematopoyéticos, mientras que, en la fase bastica la células stem leucémicas ganan capacidad invasiva, lo que les permite infiltrar otros órganos como por ejemplo, hígado y bazo, resultando en esplenomegalia progresiva.
El proceso de transformación de la fase crónica a la acelerada o a la fase blástica pareciera ocurrir por nuevas alteraciones genéticas complejas.
En las etapas iniciales de la LMC, la mayoría de los pacientes son asintomáticos.
Con frecuencia, se sospecha la LMC cuando un hemograma de rutina revela leucocitosis y basofilia.
En la fase crónica, cuando la mayoría de los pacientes son diagnosticados, los síntomas más frecuentes son fatiga, pérdida de peso, sudor frio y dolor abdominal o saciedad precoz debidos a la esplenomegalia
La LMC requiere para su diagnóstico un mínimo de los siguientes pasos:
Historia clínica y examen físico, hemograma con fórmula leucocitaria diferencial, análisis químicos de función hepática, renal y metabolismo, panel de hepatitis B y C, examen de aspirado de medula ósea y la reacción reversa de transcripción de polimerasa (RT-PCR).
En el pasado, el tratamiento de la LMC se basaba en reducir el recuento de leucocitos con drogas como el busulfan o hidroxiurea, que ya han sido abandonadas en la actualidad.
Lo mismo ocurrió con el interferón que fue usado en primera línea por proveer mejor sobrevida y repuesta molecular que los dos mencionados.
El curso natural de la fase crónica procedía irremediablemente a la aceleración y a fase blástica con mínimos recursos terapéuticos para su manejo, aun incluyendo el trasplante de medula ósea.
Con la introducción del primer inhibidor de tirosina quinasa para estudios clínicos a principios de la década del 2000, se produjo un cambio radical del tratamiento de la LMC, demostrando que el imatinib una pequeña molécula administrada por vía oral, era muy superior en respuestas cito genéticas, moleculares y sobrevida comparada con el mejor tratamiento disponible hasta entonces, interferón asociado a dosis bajas de citarabina.
Desde ese momento, el imatinib se utilizó y aun se utiliza en el tratamiento de la LMC en su fase crónica.
Mecanismo de acción del Imatinib
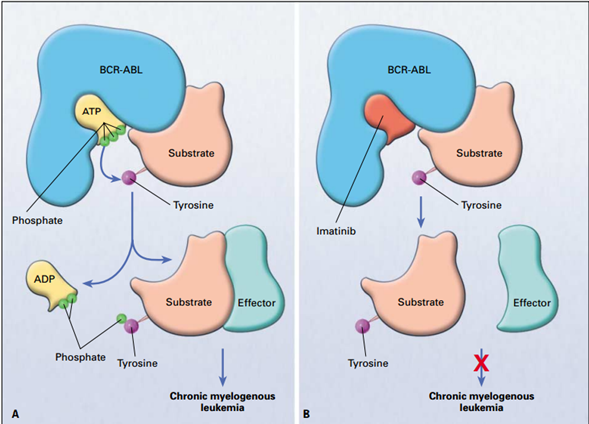
En el panel A se muestra la oncoproteina BCR-ABL con una molécula de ATP en el bolsillo de la quinasa. El sustrato es activado por la fosforilación de un residuo de tirosina induciendo la activación de otras moléculas efectoras en cascada. En panel B, se observa que cuando el Imatinib ocupa el bolsillo de quinasa en forma competitiva, la acción del BCR-ABL es inhibida al prevenir la fosforilación.
Imatinib mesylate_New oral targeted therapy.
Savage, D.G.; and Hantman, K.H. NEJM feb 28, 2002.
Vol 346, Número 9.
Con tratamiento continuo de imatinib, aproximadamente el 90 % de los pacientes con LMC, logran sobrevida similar a las personas sin LMC. Sin embargo, el 10 % restante de pacientes presentan resistencia a imatinib, mostrando la falla en lograr respuesta molecular y requieren inhibidores de tirosina quinasa de segunda o tercera generación.
En la actualidad, otros inhibidores de tirosina quinasa han incrementado los recursos terapéuticos a saber:, nilotinib, dasatinib, ponatinib y otros más con indicaciones precisas.
El objeto de la terapia de la LMC hasta hace unos años fue retardar la progresión a la fase blástica, minimizar, síntomas, y aumentar la sobrevida global que ya se logra en la mayoría de los pacientes en la actualidad.
Nuevos objetivos se están definiendo, como es la posibilidad de remisión libre de tratamiento que conlleva la suspensión del tratamiento con Imatinib, con remisiones moleculares óptimas y sostenidas por un periodo prolongado de más de 5 años.
Numerosos estudios controlados se están llevando a cabo en el mundo, incluyendo a nuestro país, para definir mejor el porcentaje de pacientes que continúan en remisión molecular continua, que no sería menor al 50 %, según datos recientes. Además, se están estudiando activamente los mecanismos probables de la diferencia entre los pacientes que sostienen la remisión libre de tratamiento y los que recaen y vuelven a requerir manejo terapéutico.
Se puede concluir que el Imatinib que fue un primer hito exitoso del manejo de pacientes oncológicos, impulsó los subsiguientes desarrollos de numerosas drogas nuevas que modifican dianas moleculares, inaugurando así la era de la medicina de precisión.







